Tetrafluorek krzemu (SiF4) ma centralny atom krzemu (Si) z 4 elektronami walencyjnymi, tworzącymi pojedyncze wiązania z czterema atomami fluoru (F), z których każdy dostarcza 7 elektronów walencyjnych. Struktura Lewisa pokazuje cztery wiązania Si-F i brak samotnych par na krzemie, wykorzystując 8 elektronów wiążących. SiF4 przyjmuje geometrię czworościenną z kątami wiązań około 109.5°, charakterystyczną dla hybrydyzacji sp3.98. Cząsteczka jest niepolarna ze względu na swój symetryczny kształt, pomimo wysokiej elektroujemności fluoru (4). Ta struktura i siła wiązań Si-F znacząco wpływają na właściwości chemiczne SiFXNUMX, w tym na jego reaktywność i rolę w przemyśle półprzewodników.

Omówmy następujący punkt w tym artykule
- jak narysować strukturę Lewisa dla SIF4
- Pojedyncze pary struktury Lewisa SIF4
- Kształt struktury Lewisa SIF4
- Reguła oktetu struktury Lewisa SIF4
- Hybrydyzacja SIF4
- Rezonans struktury Lewisa SIF4
- SIF4 polarny lub niepolarny
- SIF4 Lewis strukturyzuje opłaty formalne
- Kształt struktury Lewisa SIF4
jak narysować strukturę Lewisa dla SIF4
Kształt cząsteczki zależy od odpychania między parą wiązań elektronów walencyjnych lub parą niewiążącą. W cząsteczce SIF4 cztery atomy fluoru są otoczone centralnym atomem krzemu. Atom krzemu ma cztery niesparowane elektrony,
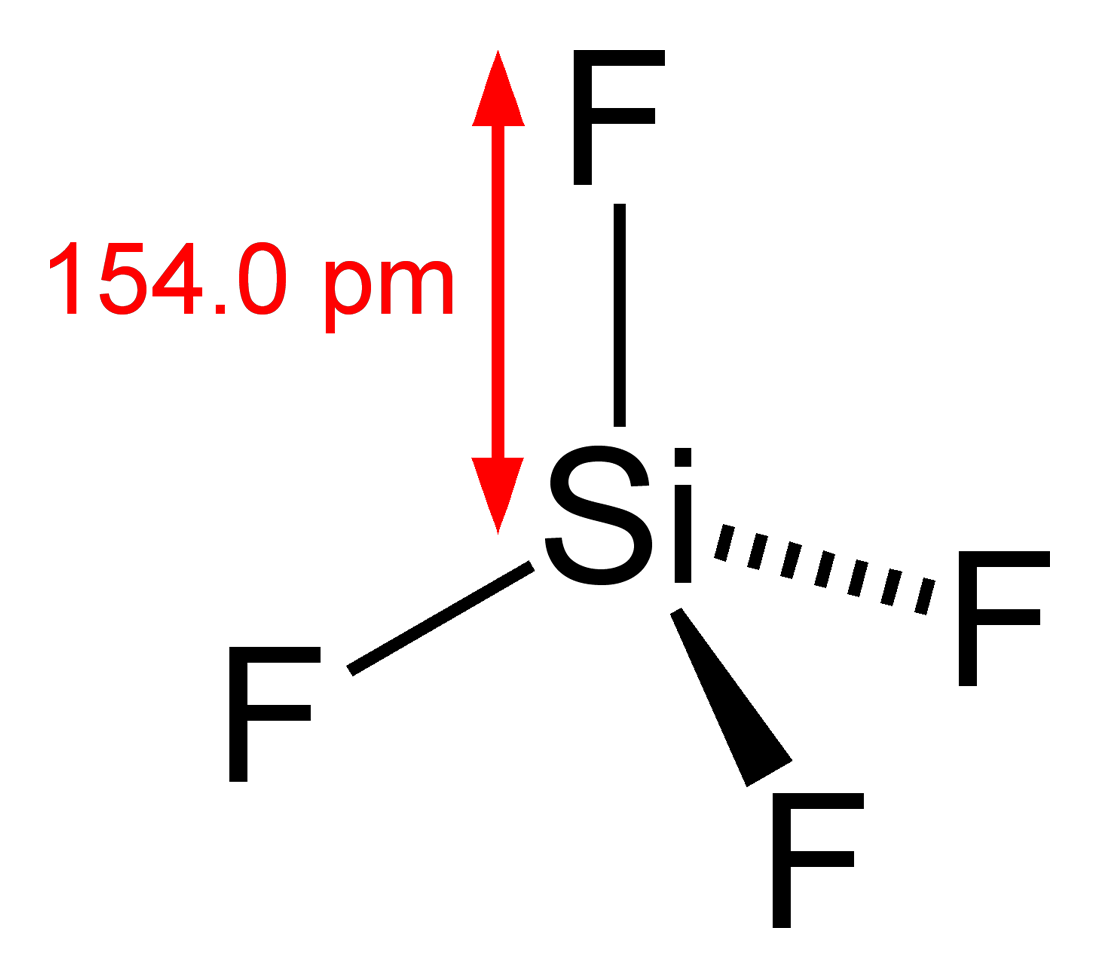
Zgodnie z zasadą oktetu krzem jest sparowany z czterema innymi atomami, aby uzupełnić swój oktet. Stąd tworzą cztery wiązania Si-F. Zgodnie z teorią VSEPR cząsteczka SiF4 ma geometrię czworościenną, z kątem wiązania 109.5o i długość wiązania 154 pm.
Pojedyncze pary struktury Lewisa SIF4
Elektron walencyjny jednego atomu krzemu= 4×1=4
Elektron walencyjny czterech atomów fluoru = 7×4=28
Całkowite elektrony walencyjne = 32 do stabilnego potrzebne jest 16 par elektronów Struktura Lewisa.
W powyższej strukturze mamy 16 par elektronów z czterema wiązaniami Si-F, więc pozostaje 12 elektronów oznaczonych samotnymi parami, dla każdego atomu fluoru są trzy samotne pary, stąd w sumie 12 samotnych par elektronów jest obecnych wokół krzemu atom,
a krzem ma zero pary elektronów, ponieważ wszystkie 12 par elektronów jest obecnych wokół czterech atomów fluoru.
Kształt struktury Lewisa SIF4

Reguła oktetu struktury Lewisa SIF4
W powyższym Struktura Lewisa, krzem i fluor nie mają żadnych ładunków, a centralny atom krzemu uzupełnia swój oktet, dlatego struktura ta jest stabilną strukturą Lewisa. Aby uzyskać stabilną strukturę Lewisa, wszystkie atomy w obecnych cząsteczkach muszą spełniać zasadę oktetu,
Reguła oktetu mówi, że aby osiągnąć stabilną konfigurację walencyjną, powłoka atomu zawiera osiem elektronów, które przypominają konfigurację elektronową najbliższego gazu szlachetnego.
W cząsteczce SiF4 atom fluoru potrzebuje tylko jednego elektronu do uzupełnienia oktetu, podczas gdy atom krzemu potrzebuje czterech elektronów do uzupełnienia oktetu i uzyskania stabilności. Atom krzemu i fluoru dzielą ze sobą jeden elektron i uzupełniają swój oktet, wodór ma dwa elektrony walencyjne, a krzem ma osiem elektronów walencyjnych, w ten sposób uzupełniają swój oktet.
Hybrydyzacja SIF4
Hybrydyzacja to proces, w którym orbitale atomowe obu atomów w cząsteczce łączą się i łączą ze sobą, tworząc hybrydowy orbital przez bezpośrednie nakładanie się wiązania sigma, podczas gdy równoległe równoległe zachodzą na siebie, tworząc wiązanie pi.
W cząsteczce SiH4 elektroniczna konfiguracja krzemu to:
Si: 1s2 2s2 2p6 3s2 3p2
Si: [Ar] 3s2 3p2

Z powyższego diagramu, orbital s i trzy orbitale p łączą się i łączą, tworząc 4 zhybrydyzowane 3p3 Orbitale te 4 orbitale hybrydowe tworzą cztery wiązania sigma z czterema atomami wodoru. Dlatego hybrydyzacja dla Si to sp3 w SiH4.
Rezonans struktury Lewisa SIF4
Rezonans jest zjawiskiem chemicznym, w którym całych właściwości cząsteczki nie da się wytłumaczyć za pomocą pojedynczej struktury. Istnieje wiele struktur kanonicznych. Ale nie każda cząsteczka może wykazywać rezonans.
SiF4 struktura Lewisa nie wykazuje rezonansu, ponieważ nie ma delokalizacji elektronów i występuje obecność wiązań pojedynczych. Więc nie ma ruchu. Mimo obecności samotnych par elektronów, delokalizacja zaburza czynnik stabilności. Stąd nie ma rezonansu struktury lewisa SiFl4 Struktura
SIF4 polarny lub niepolarny
Cztery atomy fluoru są otoczone centralnym atomem krzemu w cząsteczce SiF4, elektroujemność atomu krzemu wynosi 1.90, a elektroujemność atomu fluoru 3.98 różnica między elektroujemnością fluoru i krzemu wynosi 2.08,
tak duża różnica elektroujemności pomiędzy krzemem i fluorem wskazuje, że pary elektronów są silnie przyciągane w kierunku atomu fluoru, stąd wiązanie Si-F w cząsteczce SiF4 jest polarne. większa różnica elektroujemności między nimi wskazuje, że para elektronów jest silnie przyciągana do atomu fluoru, stąd wiązanie Si-F jest wysoce polarne.
SIF4 Lewis strukturyzuje opłaty formalne
W cząsteczce tetrafluorku krzemu liczba ładunków rzeczywistych odpowiada całkowitym ładunkom formalnym. Opłaty formalne naliczane są przez SiF4 Struktura kropki Lewisa. Które są obliczane według następującego wzoru,
Ładunek formalny na atomie Si cząsteczki SiF4 = elektron walencyjny pary silonowej krzemu -1/2 (wiązana para elektronów)
Zgodnie z formalną formułą obliczania ładunku atom krzemu ma 4 elektrony walencyjne, osiem elektronów wiązania i nie ma samotnej pary. stąd , W cząsteczce SiF4 Dlatego formalny ładunek na atomie krzemu cząsteczki SiF4 = (4-0-(8/2)) =0
Stąd formalne ładunki w cząsteczce SiF4 wynoszą zero.
Kształt struktury Lewisa SIF4
Czworościenna struktura SiF4 Pokazano poniżej:
Często Zadawane Pytania
Jaka jest struktura Lewisa SiF4?
Odpowiedź: W Struktura Lewisa z cząsteczki SiF4 centralny atom krzemu jest otoczony czterema atomami fluoru, tworzy cztery wiązania Si-F, wszystkie atomy fluoru mają po trzy wolne pary na każdym.
Jakie są podobieństwa i różnice między strukturami Lewisa XeO3 i SIF4?
Połączenia Wyjaśniono strukturę Lewisa xeo3 ujawnia, że zarówno XeO3, jak i SiF4 mają centralne atomy otoczone parami elektronów i parami wiązań. Jednak kluczowa różnica polega na liczbie par elektronów i kątach wiązań. XeO3 ma 3 pary wiązań i 2 wolne pary, co daje kształt trójkątnej piramidy z kątami wiązań wynoszącymi około 109.5°. Z drugiej strony SiF4 ma 4 pary wiązań i żadnych samotnych par, co nadaje mu kształt czworościenny z kątami wiązań wynoszącymi 109.5°.
Jak przewidujesz kształt SiF4?
Odpowiedź: Kształt SiF4 jest przewidywany przez teorię VSEPR. Centralny atom krzemu ma cztery elektrony walencyjne, stąd jest związany z czterema atomami fluoru i tworzy geometrię czworościenną.
Jakie jest znaczenie struktury Lewisa?
Odpowiedź: Określa naturę wiązania i położenie atomów cząsteczki, które są połączone w cząsteczce. Przedstawienie cząsteczek w strukturze kropki elektronowej Lewisa lub po prostu w strukturze Lewisa jest na cześć amerykańskiego chemika Gilberta Newtona Lewisa.
Przeczytaj także:
- Struktura Lewisa Ncl2
- Struktura Lewisa Co2
- Struktura Bao Lewisa
- Struktura Lewisa Sncl2
- Struktura Lewisa H2SO4
- Struktura Lewisa Xecl2
- Struktura Lewisa Chf3
- Struktura Lewisa Na2so4
- Struktura Lewisa Bf3
- Struktura Lewisa H2O2

Cześć… Jestem Darshana Fendarkar, ukończyłem doktorat. z Uniwersytetu w Nagpur. Moją specjalizacją jest Chemia Nieorganiczna.
Mam doświadczenie jako chemik w Earthcare Pvt. z oo Posiadam również 2-letnie doświadczenie w nauczaniu. Obecnie współpracuję z Lambdageek jako ekspert merytoryczny.

