Jak znaleźć reakcję Redox

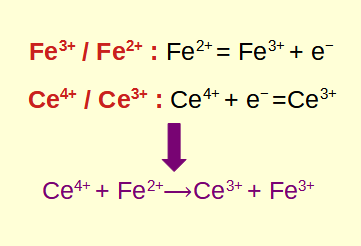

Reakcje redoks, w skrócie reakcje utleniania i redukcji, to podstawowe procesy chemiczne polegające na przenoszeniu elektronów pomiędzy reagentami. Zrozumienie sposobu identyfikowania i obliczania reakcji redoks ma kluczowe znaczenie w chemii i biologii. W tym poście na blogu omówimy podstawy reakcji redoks, dowiemy się, jak je zidentyfikować, zagłębimy się w obliczenia i odkryjemy ich praktyczne zastosowania.
Zrozumienie podstaw reakcji redoks
Reakcje redoks zachodzą, gdy następuje transfer elektronów między dwoma gatunkami. Jeden gatunek traci elektrony (poddaje się utlenianiu), podczas gdy drugi zyskuje elektrony (poddaje się redukcji). Ten transfer elektronów jest napędzany różnicą elektroujemności zaangażowanych atomów.
Utleniona forma jest znana jako środek redukujący, ponieważ oddaje elektrony, podczas gdy zredukowana forma nazywana jest środkiem utleniającym, ponieważ przyjmuje elektrony. Należy zauważyć, że reakcje redoks zawsze obejmują zarówno utlenianie, jak i redukcję, stąd nazwa.
Znaczenie reakcji redoks
Reakcje redoks odgrywają kluczową rolę w różnych procesach chemicznych i biologicznych. Biorą udział w wytwarzaniu energii, korozji, syntezie substancji chemicznych, a nawet funkcjonowaniu naszego własnego organizmu. Na przykład proces fosforylacji oksydacyjnej zachodzący w mitochondriach naszych komórek opiera się na reakcjach redoks prowadzących do wytworzenia ATP, uniwersalnej waluty energetycznej komórek.
Typowe przykłady reakcji redoks
Rzućmy okiem na kilka typowych przykładów reakcji redoks:
Spalanie: Kiedy substancja reaguje z tlenem, wytwarzając ciepło i światło, jest to reakcja redoks. Na przykład spalanie drewna lub spalanie benzyny w silniku samochodowym.
Rdzewienie: Proces rdzewienia polega na utlenianiu żelaza w obecności tlenu i wody. Żelazo traci elektrony, tworząc tlenek żelaza (III) (rdzę).
Fotosynteza: Podczas fotosyntezy rośliny przekształcają dwutlenek węgla i wodę w glukozę i tlen za pomocą światła słonecznego. Proces ten polega na redukcji dwutlenku węgla i utlenianiu wody.
Identyfikacja reakcji redoks
Aby zidentyfikować reakcję redoks, musimy rozpoznać substancje podlegające utlenianiu i redukcji. Oto kilka kluczowych kroków, które pomogą nam szybko zidentyfikować reakcje redoks:
Rozpoznawanie utleniania i redukcji: Poszukaj zmian w stopniach utlenienia lub utraty/zysku elektronów. Jeśli stopień utlenienia pierwiastka wzrasta, oznacza to, że jest on utleniany, natomiast spadek stopnia utlenienia wskazuje na redukcję.
Określanie stopnia utlenienia: Stopień utlenienia to pojęcie stosowane do określenia rozkładu elektronów w związku lub jonie. Pomaga nam zidentyfikować zmianę stopni utlenienia podczas reakcji redoks.
Szybka identyfikacja reakcji redoks: Jedną ze skutecznych metod identyfikacji reakcji redoks jest sprawdzenie obecności pewnych pierwiastków lub związków, o których wiadomo, że ulegają reakcjom redoks. Na przykład nadtlenek wodoru (H2O2) jest powszechnym środkiem utleniającym, podczas gdy substancje takie jak borowodorek sodu (NaBH4) są środkami redukującymi.
Obliczanie reakcji redoks
Po zidentyfikowaniu reakcji redoks możemy przystąpić do jej obliczenia. Oto jak:
Znajdowanie reakcji połówkowych: Podziel reakcję redoks na dwie reakcje połówkowe, jedną reprezentującą utlenianie, a drugą reprezentującą redukcję. Pomaga to w późniejszym zbilansowaniu równania.
Równoważenie reakcji redoks: Zrównoważ liczbę atomów po każdej stronie równania, dostosowując współczynniki. Podczas reakcji redoks niezbędne jest zrównoważenie masy i ładunku.
Obliczanie całkowitej reakcji redoks: Połącz zrównoważone reakcje połówkowe, upewniając się, że liczba elektronów uzyskanych w wyniku redukcji odpowiada liczbie elektronów utraconych podczas utleniania.
Zaawansowane koncepcje w reakcjach redoks
Aby pogłębić nasze zrozumienie reakcji redoks, przyjrzyjmy się kilku zaawansowanym koncepcjom:
Określanie spontaniczności reakcji redoks: Spontaniczność reakcji redoks można określić, korzystając z koncepcji potencjału redoks. Jeśli potencjał redoks jest dodatni, reakcja jest spontaniczna, co wskazuje na większe prawdopodobieństwo wystąpienia.
Znalezienie współczynnika reakcji redoks: Współczynniki w zrównoważonej reakcji redoks reprezentują względną liczbę moli każdego zaangażowanego gatunku. Współczynniki te są istotne w obliczeniach stechiometrycznych.
Zrozumienie roli elektronów w reakcjach redoks: Elektrony są nośnikami ładunku w reakcjach redoks. Podróżują od środka redukującego do utleniacza, ułatwiając transfer energii.
Praktyczne zastosowania reakcji redoks
Reakcje redoks mają praktyczne zastosowania w różnych dziedzinach. Przeanalizujmy kilka przykładów:
Reakcje redoks w życiu codziennym: Proces oddychania w naszym organizmie opiera się na reakcjach redoks, które przekształcają glukozę w energię. Dodatkowo baterie, których używamy na co dzień, takie jak baterie alkaliczne i baterie litowo-jonowe, działają w oparciu o reakcje redoks.
Przemysłowe zastosowania reakcji redoks: Reakcje redoks mają kluczowe znaczenie w procesach przemysłowych, takich jak ekstrakcja metali, galwanizacja i oczyszczanie ścieków. Pomagają usunąć szkodliwe zanieczyszczenia i przekształcić je w mniej toksyczne substancje.
Reakcje redoks w układach biologicznych: W organizmie człowieka reakcje redoks biorą udział w różnych procesach biologicznych, w tym w metabolizmie, detoksykacji i odpowiedziach immunologicznych. Jednak nadmierne reakcje redoks mogą prowadzić do stresu oksydacyjnego, który może uszkadzać komórki i przyczyniać się do chorób.
Przeczytaj także:
- Reakcja Knoevenagela
- Przykład reakcji zależnej od światła
- Reakcja endotermiczna
- Reakcja podstawienia nukleofilowego
- Przykład reakcji syntezy
- Reakcja fotochemiczna
- Przykład reakcji endergonicznej
- Przykład reakcji pierwszego rzędu
- Przykład reakcji niezależnej od światła
- Reakcja Kolbego

Cześć,
Nazywam się Aditi Ray i jestem MŚP z branży chemicznej na tej platformie. Ukończyłem studia z chemii na Uniwersytecie w Kalkucie oraz studia podyplomowe na Uniwersytecie Techno India ze specjalizacją w chemii nieorganicznej. Bardzo się cieszę, że jestem częścią rodziny Lambdageeks i chciałbym w prosty sposób wyjaśnić temat.
Połączmy się przez LinkedIn-https://www.linkedin.com/in/aditi-ray-a7a946202
