Poziom energii
- Poziomy powłoki elektronowej lub energii będą określonymi odległościami od jądra atomu, w których można znaleźć elektrony lub z najwyższym prawdopodobieństwem ich znalezienia. Elektrony to ujemnie naładowane cząsteczki w cząsteczce, które poruszają się wokół dodatniego jądra, zwykle zlokalizowanego w centrum. Poziomy energii są nieco podobne do miar skoków elektronów kroku.
- W większości podstawowych pojęć atomu; składają się z elektronów krążących wokół jądra.
- Chociaż elektrony nie są w stanie wybrać żadnej orbity zgodnie z ich życzeniem. Elektrony są ograniczone do orbit o określonym poziomie energii. Elektrony są w stanie przeskoczyć tylko z jednego poziomu energii lub przejść na inny poziom. Elektrony nie mogą orbitować z energiami innymi niż określone poziomy energii.
Jaki jest wykres poziomu energii?
Poziom energii pozwala oszacować ilość energii, jakiej elektron może wymagać i zostanie uwolniony podczas przejścia, jeśli przeskoczy z jednej orbity na drugą. Stan podstawowy lub zerowy to stan minimalnej energii obliczony dla H.2 Cząsteczki.

Jakie są cztery poziomy energii?
Istnieją cztery typy orbitali - s, p, d i f.
- Ostry-s
- Zasada-p
- Rzutowy
- Fundamentalna-f
W atomie istnieje kilka ich kombinacji orbitale.
Poziom energii to ilość przestrzeni lub regionów, gdziekolwiek elektrony prawdopodobnie będzie obecny. Odległości te, znane jako orbitale, mają różne kształty, oznaczone literą (s, p, d, f).

maniakiem3, Chmury orbitalne atomów SPDF M0, CC BY-SA 4.0
Jak określasz poziom energii?

BruceBlaus, Blausen 0342 Poziomy energii elektronów, CC BY 3.0
elektrony walencyjne
„Elektrony o najwyższym poziomie energii nazywane są elektronami walencyjnymi”.
Stan podstawowy
„Minimalny stan równowagi energetycznej H2 atom jest uznawany za stan podstawowy ”.
Stan podniecenia
Kiedy elektron (lub atom) ma wyższą energię niż ta najniższa energia, mówi się, że jest w „stanie wzbudzonym”.
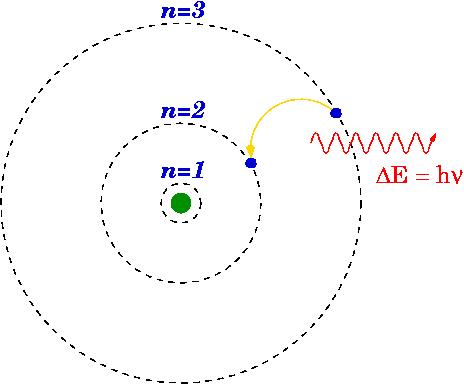
Jeśli elektron spadnie z wyższego poziomu na niższy, może wyemitować foton lub uwolnić energię.
Różnica energii
Energia wyemitowanego fotonu jest różnicą między poziomami energii pierwotnej (n i ) i końcowe (n f ) stan. Energię emitowanego fotonu oblicza się za pomocą wzoru Rydberga.
Model wodoru Bohra
W 1913 roku Niels Bohr opracował koncepcje poziomów energii i częstotliwości widmowejn H2 rozważając różne proste założenia, aby naprawić hipotetyczne klasyczne. Większość tych wad została rozwiązana przez modyfikację modelu Bohra autorstwa Arnolda Summerfielda. Za ten model fizyk Niels Bohr otrzymał Nagrodę Nobla w dziedzinie fizyki w 1922 roku.
W podstawowej koncepcji atomu (model atomowy Bohra) elektrony obracają się tylko po pewnych orbitach wokół jądra. Poza emisją lub pochłanianiem energii zachodzą elektrony schodzące w dół i w górę między dozwolonymi orbitami.
Chociaż ten podstawowy model nie jest dobrze przyjęty, ponieważ większość struktury atomów jest bardziej skomplikowana niż wodór, chociaż wymaga to nowych tematów, stąd wprowadzenie mechaniki kwantowej, w mechanice kwantowej każdy orbitujący elektron jest wyjaśniony za pomocą wyrażenia matematycznego znanego jako funkcja falowa.
WierzbaW, Model atomu Bohra, CC BY-SA 3.0
Promień Bohra
„Promień Bohra (a0) jest parametrem stałym, równym najbardziej przewidywalnej odległości atomu wodoru między jądrem a elektronem w stanie podstawowym (nierelatywistyczna i posiadająca nieskończenie ciężki proton)"
Został nazwany na cześć Nielsa Bohra ze względu na jego udział w modelu atomu Bohra.

SE3-29X, Wodór GIF, CC BY-SA 4.0
Linie widmowe
Każdy składnik ma określony zestaw poziomów energii. Zatem częstotliwości, w których pochłania i emituje światło, zachowują się jak rodzaj mikrofonu, identyfikując konkretny związek i konkretny. Te cechy atomów dały możliwość zbadania przedmiotów zwanych spektroskopią, nauką poświęconą identyfikowaniu cząsteczek i atomów na podstawie rodzaju promieniowania, które pochłaniają lub emitują.
Seria Balmer
Fizyk atomowy Balmer analitycznie zauważył zależność między energiami podczas uwalniania fotonów z atomu. Różne dyskretne energie / długości fal fotonów, które zostały odkryte przez Balmera, nazywane są serią Balmera.
Później było wiadomo, że przejścia energii tworzą linie Balmera z atomu wodoru. Model Bohra atomu zdołał przeliterować szereg Balmera, ponieważ większe orbity wymagały elektronów, aby miały znacznie więcej niekorzystnej mocy lub energii ujemnej, aby zrównoważyć moment pędu. Formuła Rydberga przyjmuje szerokie spojrzenie na serię Balmera dla wszystkich regulacji poziomu energii.
Spektrum emisji
Połączenia spektrum emisji atomowego wodoru podzielono na liczne szeregi widmowe i długości fal, które zapewniała standardowa formuła Rydberga. Te wykryte linie widmowe są wynikiem przejścia elektronów z różnych poziomów energii w atomie.
Widmo emisyjne oznacza różnorodność długości fal emitowanych przez atom lub związek chemiczny stymulowane przez ogrzewanie lub prąd elektryczny. Widmo emisyjne spalającego się gazu lub innych cząsteczek można również wykorzystać do zilustrowania jego składu.
Kredytowych Image: Ranjithsiji, Atomowe widmo emisyjne helu, CC BY-SA 4.0
Energia potencjalna
„Jest to energia istoty odpowiadająca jej położeniu względem innych obiektów, naprężeń, zmagazynowanego ładunku elektrycznego lub innych czynników w sobie ”.
Energia wiązania
„Energia wiązania to minimalna energia potrzebna do utrzymania razem jądra”.
Energia jonizacji
"Ilość energii, którą izolowany atom w podstawowym stanie elektronowym wymagał zaabsorbowania, aby został wyładowany jako e- "
Energia jonizacji jest opisywana jako trudny krok w usuwaniu elektronu z atomu lub jonu lub zdolność atomu lub jonu do oddania elektronu. Redukcja liczby elektronów zwykle ma miejsce w stanie podstawowym gatunku.
Energie jonizacji są mierzone w kJ / mol lub ilości energii potrzebnej do poluzowania wszystkich atomów w molu e- odpowiednio.
Jak działa energia jonizacji?
Energia jonizacji to wymagana energia, w której izolowany, gazowy atom z podstawowego stanu elektronicznego powinien wchłonąć, aby uwolnić elektron. Im więcej utraconych elektronów, tym więcej + ve tego jonu będzie i trudniej będzie oddzielić e- od atomu.
Który pierwiastek ma najwyższą i najniższą energię jonizacji?
- Pierwiastek Ma najwyższą energię jonizacji.
- Wapń ma minimalną energię jonizacji.
Energia jonizacji pierwiastka staje się wyższa od lewej do prawej w układzie okresowym i spada z góry na dół ogólnie w układzie okresowym.
CDang i Adrignola, Okresowy układ energii jonizacji, CC BY-SA 3.0
Więcej informacji na temat chmury elektronowej Kliknij tutaj
Przeczytaj także:
- Czy energia potencjalna jest zmagazynowana energia?
- Rodzaje energii kinetycznej
- Przykład zamiany energii elektrycznej na energię promieniowania
- Przykład energii mechanicznej na elektryczną
- Energia grawitacyjna na energię mechaniczną
- Formuła energii wiatrowej
- Czy masa wpływa na energię potencjalną
- Energia promienista na energię chemiczną
- Energia chemiczna na energię dźwiękową
- Przykład energii kinetycznej na dźwiękową

Jestem Subrata, doktor. inżynier, ze szczególnym uwzględnieniem dziedzin pokrewnych naukom jądrowym i energetycznym. Posiadam wielodziedzinowe doświadczenie począwszy od Inżyniera Serwisu ds. napędów elektronicznych i mikrokontrolerów po specjalistyczne prace badawczo-rozwojowe. Pracowałem nad różnymi projektami, w tym nad rozszczepieniem jądrowym, syntezą jądrową do fotowoltaiki, projektowaniem grzejników i innymi projektami. Interesuję się dziedziną nauki, energią, elektroniką i oprzyrządowaniem oraz automatyką przemysłową, przede wszystkim ze względu na szeroki zakres stymulujących problemów odziedziczonych w tej dziedzinie, a która każdego dnia zmienia się wraz z zapotrzebowaniem przemysłu. Naszym celem jest zilustrowanie tych niekonwencjonalnych, złożonych przedmiotów ścisłych w sposób łatwy i zrozumiały.
